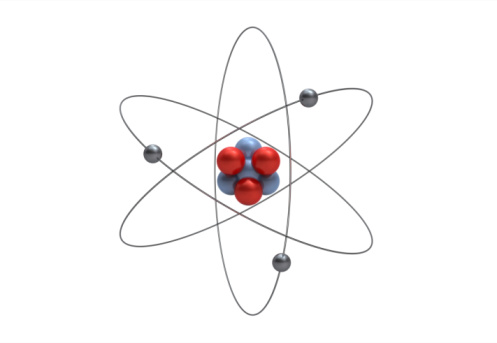
लिथियम एक रासायनिक तत्व है जिसका परमाणु क्रमांक 3 है। यह सबसे हल्का ठोस तत्व है और इसका रंग चांदी-सफेद है। लिथियम के इलेक्ट्रॉन 1s कक्षीय में हैं, इसलिए वे रासायनिक प्रतिक्रियाओं में भाग नहीं लेते हैं। इसलिए लिथियम का इलेक्ट्रॉन विन्यास 1s²2s¹ है। लिथियम की कम प्रतिक्रियाशीलता इसे बैटरी के लिए उपयोगी बनाती है, जो अन्य पदार्थों के साथ प्रतिक्रिया किए बिना ऊर्जा को स्टोर और रिलीज कर सकती है।
A Basic Info about Lithium
| Atomic number (Z) | 3 |
| Group | group 1: hydrogen and alkali metals |
| Period | period 2 |
| Block | s-block |
| Electron configuration | [He] 2s1 |
| Electrons per shell | 2, 1 |
Lithium क्या है (What is lithium)

लिथियम एक रासायनिक तत्व है जिसका प्रतीक li और परमाणु संख्या 3 है। यह एक नरम, चांदी-सफेद धातु है जो रासायनिक तत्वों के क्षार धातु समूह से संबंधित है। अपने मौलिक रूप में, यह बहुत प्रतिक्रियाशील नहीं है।
लिथियम का उपयोग कुछ प्रकार की बैटरियों में किया गया है और इसका मूड स्थिर करने वाले प्रभावों के कारण मनुष्यों में द्विध्रुवी विकार के संभावित उपचार के रूप में अध्ययन किया गया है।
- Hydrogen क्या है, खोज, गुण, उपयोग, समस्थानिक (What is Hydrogen, Discovery, Properties, Uses, Isotopes
- Helium क्या है, खोज, गुण, उपयोग, समस्थानिक (What is Helium, Discovery, Properties, Uses, Isotopes in Hindi)
लिथियम का परमाणु द्रव्यमान(Atomic Mass of Lithium)
लिथियम का परमाणु द्रव्यमान लगभग 6.94 है। लिथियम का परमाणु द्रव्यमान लगभग 6.94 है। लिथियम का द्रव्यमान 6.94 ग्राम प्रति मोल (g/mol) है। इसका मतलब है कि लिथियम के एक मोल में कणों की संख्या परमाणु भार (6.94 ग्राम / 6.938 ग्राम) से विभाजित परमाणु द्रव्यमान के बराबर होती है।
Lithium की खोज (Discovery of Lithium)
लिथियम एक क्षार धातु है जिसका उपयोग बैटरी के निर्माण में किया जाता है। लिथियम की खोज 1817 में जोहान ऑगस्ट अरफवेडसन ने की थी। लिथियम एक नरम, चांदी-सफेद धातु है जो अत्यधिक प्रतिक्रियाशील और ज्वलनशील है। लिथियम में किसी भी ठोस तत्व का घनत्व सबसे कम होता है और किसी भी धातु का आयतन सबसे कम होता है। इसका दूसरा सबसे कम गलनांक और सभी धातुओं का सबसे कम क्वथनांक है।
लिथियम की खोज का श्रेय 1817 में जोहान ऑगस्ट अरफवेडसन को जाता है, जब उन्होंने इसे स्वीडन के उप्साला के पास एक झरने से खनिज पानी में पाया। उन्होंने इसका नाम ग्रीक शब्द स्टोन (लिथोस) के नाम पर रखा क्योंकि यह एक पत्थर की खदान के पास एक खदान में पाया गया था।
लिथियम के समस्थानिक(Isotopes of Lithium)
लिथियम के समस्थानिक रासायनिक तत्वों का एक समूह है जिसमें समान संख्या में प्रोटॉन होते हैं लेकिन विभिन्न संख्या में न्यूट्रॉन होते हैं। उन्हें उनके परमाणु द्रव्यमान द्वारा परिभाषित किया जाता है जो 7 से अधिक है, लेकिन 8 से कम है।
प्रकृति में सबसे आम समस्थानिक लिथियम -6 और लिथियम -7 हैं, जिनमें क्रमशः 3 और 2 न्यूट्रॉन होते हैं। लिथियम -6 का परमाणु द्रव्यमान 6.941 amu है, जबकि लिथियम -7 का परमाणु द्रव्यमान 7.0128 amu है।
लिथियम के गुण (Properties of Lithium)
लिथियम एक नरम, चांदी-सफेद धातु है जो रासायनिक रूप से बहुत प्रतिक्रियाशील है। इसमें सभी धातुओं का घनत्व सबसे कम होता है और यह सबसे कम सघन ठोस तत्व होता है। लिथियम के सबसे महत्वपूर्ण गुणों में से एक अन्य तत्वों के साथ इसकी कम प्रतिक्रियाशीलता है। यह इसे बैटरी और अन्य उपकरणों में उपयोग करने की अनुमति देता है जिनके लिए गैर-प्रतिक्रियाशील धातुओं की आवश्यकता होती है।
लिथियम एक रासायनिक तत्व है जिसका प्रतीक Li है। यह एक नरम, चांदी-सफेद धातु है जो क्षार धातु समूह से संबंधित है और इसकी परमाणु संख्या 3 है। लीथियम को आवर्त सारणी में ली के रूप में दर्शाया गया है, इसके बाहरी आवरण के बाहर तीन इलेक्ट्रॉन और इसके आंतरिक खोल में एक इलेक्ट्रॉन है। लिथियम के सबसे आम समस्थानिक (Li-6) का परमाणु भार 6.94 है और यह पूरी प्रकृति में ट्रेस मात्रा में पाया जाता है, हालांकि यह आमतौर पर लिथियम क्लोराइड (LiCl) जैसे लवण के रूप में होता है।
लिथियम के गुणों को दो श्रेणियों में वर्गीकृत किया जा सकता है: भौतिक गुण और रासायनिक गुण। भौतिक गुण वे हैं जो उन गुणों को मापते हैं जो रसायन विज्ञान से संबंधित नहीं हैं जैसे घनत्व या गलनांक जबकि रासायनिक गुण वे हैं जो रसायन विज्ञान से संबंधित गुणों को मापते हैं जैसे कि घुलनशीलता etc.
- प्रकाश क्या है, परिभाषा, गुण, प्रकाश की गति (What is Light definition, properties of light, speed of light)
- विद्युत-क्षेत्र क्या है(Electric field in Hindi) विद्युत-क्षेत्र की तीव्रता किसे कहते है, परिभाषा, मात्रक( electric field meaning in Hindi)
लिथियम का उपयोग (Uses of Lithium)
लिथियम एक रासायनिक तत्व है जिसका प्रतीक ली और परमाणु संख्या 3 है। यह एक नरम, चांदी-सफेद धातु है जो रासायनिक तत्वों के क्षार धातु समूह से संबंधित है। लिथियम में सभी धातुओं का सबसे कम गलनांक और क्वथनांक होता है, और इसका एकमात्र स्थिर ऑक्साइड लिथियम ऑक्साइड (LiO) होता है। लिथियम का घनत्व कम होता है, अधिकांश अन्य धातुओं की तुलना में हल्का होता है।
लिथियम के यौगिकों का उपयोग मुख्य रूप से लिथियम आयन बैटरी और फार्मास्यूटिकल्स में किया जाता है, जिसमें एंटीसाइकोटिक्स भी शामिल है। लिथियम आयनों का उपयोग चिकित्सा अनुसंधान में मनुष्यों और अन्य जानवरों में द्विध्रुवी विकार के लिए मूड स्टेबलाइजर्स के रूप में किया जाता है। इसमें परमाणु रिएक्टर नियंत्रण छड़ और एमआरआई मशीनों और एक्स-रे मशीनों जैसे चिकित्सा इमेजिंग उपकरण में भी अनुप्रयोग हैं।
लिथियम आयनों का उपयोग किया जाता है
- -बैटरी: इलेक्ट्रिक कारों और अन्य इलेक्ट्रिक वाहनों के साथ-साथ मोबाइल फोन, लैपटॉप और अन्य इलेक्ट्रॉनिक उपकरणों के लिए बिजली प्रदान करने के लिए;
- -मिश्र धातु: हल्के लेकिन मजबूत विमान के पुर्जे बनाने के लिए;
- -मेडिसिन: लिथियम का उपयोग मिजाज और द्विध्रुवी विकार के इलाज के लिए किया जा सकता है।
लिथियम में न्यूट्रॉन की संख्या(Number of neutrons in lithium)
लिथियम में न्यूट्रॉन की संख्या 3 और प्रोटॉन की संख्या 3 होती है। लिथियम परमाणु में न्यूट्रॉन की संख्या तीन होती है, जबकि प्रोटॉन की संख्या तीन होती है।
Lithium carbonate क्या है, इसके उपयोग (Lithium carbonate , Uses of Lithium carbonate)
लिथियम कार्बोनेट एक रासायनिक यौगिक है जिसका सूत्र Li2CO3 है। इसका उपयोग कुछ प्रकार की लिथियम-आयन बैटरी में इलेक्ट्रोलाइट के रूप में किया जाता है। लिथियम कार्बोनेट एक सफेद पाउडर है जो पानी में घुलनशील है, लेकिन इथेनॉल या ईथर में नहीं।
इलेक्ट्रोलाइट के रूप में लिथियम कार्बोनेट का उपयोग कई वर्षों से जाना जाता है, लेकिन 1978 तक ऐसा नहीं था कि इसका उपयोग करने वाली पहली व्यावसायिक बैटरी बाजार में आई। इस इलेक्ट्रोलाइट युक्त लिथियम-आयन बैटरी के फायदे उनकी उच्च ऊर्जा घनत्व और लंबे जीवन हैं। नुकसान उनके अपेक्षाकृत कम बिजली घनत्व और उच्च स्व-निर्वहन दर हैं, जो उन्हें बिजली के वाहनों और निर्बाध बिजली आपूर्ति जैसे अनुप्रयोगों के लिए अनुपयुक्त बनाते हैं।
क्या lithium toxic होता है (is lithium toxic)
लिथियम एक चांदी-सफेद धातु है जिसका उपयोग बैटरी और सिरेमिक जैसे कई उत्पादों में किया जाता है। लिथियम विषाक्त नहीं है। यह तत्वों की आवर्त सारणी में सबसे कम विषैले तत्वों में से एक है। लिथियम विषाक्त हो सकता है अगर यह बड़ी मात्रा में शरीर में प्रवेश करता है, लेकिन इसके लिए बड़ी मात्रा में लिथियम धूल या धुएं को निगलने या सांस लेने की आवश्यकता होगी।
 Skip to content
Skip to content